Kuis 3. Buatlah 2 soal (Per Chapter) pilihan ganda dari tugas kelompok lain (Chapter 1 s/d 12 (Selain chapter anda))
a. Elekcron valensi
b. Kecendrungan membentuk konfigurasi electron gas mulia
c. Lintasan electron
d. Neutron dalam inti atom
e. Proton dan neutron
Jawaban : B
Pembahasan:
Unsur-unsur gas mulia sukar bereaksi karena unsur-unsur tersebut tergolong unsur yang stabil. Menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Setiap atom dalam pembentukan senyawa membentuk konfigurasi electron yang stabil, yaitu :
- Konfigurasi electron gas mulia yang disebut konfigurasi octet atau kaidah oktet,
- Sedangkan Helium disebut kaidah duplet.
Atom-atom suatu unsur berusaha mencapai konfigurasi octet atau duplet dengan cara berikatan dengan atom-atom lain.
Ikatan yang terjadi dapat berupa ikatan ion, kovalen dan kovalen koordinasi.
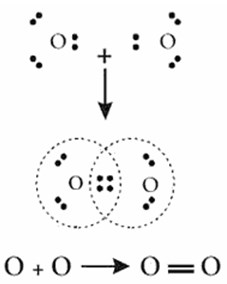
2. Di antara molekul-molekul dibawah ini, yang mempunyai ikatan kovalen rangkap dua adalah . . .
a. N2 (nomor atom N = 7)
b. O2 (nomor atom O = 8)
c. H2 (nomor atom H = 1)
d. H2O
e. NH3
Jawaban : B
Pembahasan:
Ikatan rangkap dua terjadi apabila dua pasang elektron berikatan.
8O = 1s2 2s2 2p4 (elektron valensi 6)
A. 17n, 18p
B. 17n, 35p
C. 18n, 17p
D. 18n, 35p
E. 35n, 17p
Jawaban : C
Pembahasan :
![]()
Nomor atom = 17
p = 17
e = 17
Nomor mass = 35
p + n = 35
n = 35 – 17 = 18
2. Jika diketahui nuklida ![]() , maka jumlah elektron, proton dan neutron adalah….
, maka jumlah elektron, proton dan neutron adalah….
A. 23 proton, 12 elektron, 11 neutron
B. 11 proton, 12 elektron, 23 neutron
C. 11 proton, 11 elektron, 12 neutron
D. 11 proton, 12 elektron, 11 neutron
E. 12 proton, 11 elektron, 11 neutron
Jawaban : C
Pembahasan :
![]()
Nomor atom = 11
p = 11
e = 11
Nomor massa = 23
p + n = 23
n = 23 – 11 = 12
a. 5 gr
b. 4 gr
c. 3 gr
d. 2 gr
e. 1 gr
Jawaban : D
Penyelesaian :

2. Jika 2 mol HNO3 ( Mr = 63 ) HNO Berapakah gram massa dari HNO3….
a. 150 gram
b. 146 gram
c. 136 gram
d. 126 gram
e. 116 gram
Jawaban : D
Penyelesaian :

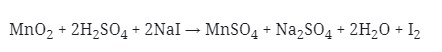
Yang berperan sebagai oksidator pada reaksi di atas adalah . . .
a. NaI
b. H2SO4
c. Mn2+
d. I–
e. MnO2
Jawaban : E
Pembahasan :
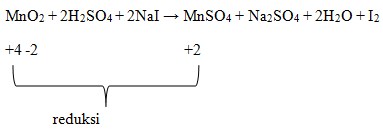
Diketahui bahwa oksidator yang mengalami reduksi atau penurunan biloks.
Dimana dilihat bahwa Mn pada MnO2 adalah +4.
Biloks Mn pad MnSO4 adalah +2.
Terjadi penurunan biloks, sehingga MnO2 menjadi oksidator.
2. Diketahui reaksi :
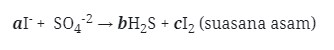
Jika reaksi diatas disetarakan makan koefisien a, b, dan c berturut-turut adalah . . .
a. 4, 1, 1
b. 4, 1, 2
c. 4, 1, 3
d. 4, 1, 4
e. 4, 1, 5
Jawaban : D
Pembahasan :
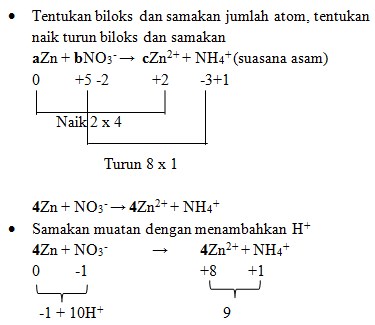
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+
- Samakan H dengan menambahkan H2O
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+ + 3H2O
Maka koefisiennya :
aZn + bNO3‾ → cZn²+ + NH4+
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+ + 3H2O
A. 8 P1
B. 2 P1
C. 1/2 P1
D. 1/4 P1
E. 1/8 P1
Jawaban : A
Pembahasan:
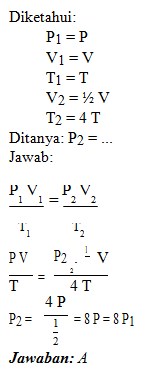
2. Sebanyak 3 liter gas Argon bersuhu 27°C pada tekanan 1 atm( 1 atm = 105 Pa) berada di dalam tabung. Jika konstanta gas umum R = 8,314 J mol−1 K−1 dan banyaknya partikel dalam 1 mol gas 6,02 x 1023 partikel, maka banyak partikel gas Argon dalam tabung tersebut adalah…..
A. 0,83 x 10²³ partikel
B. 0,72 x 10²³ partikel
C. 0,42 x 10²³ partikel
D. 0,22 x 10²³ partikel
E. 0,12 x 10²³ partikel
Jawaban : B
Pembahasan:

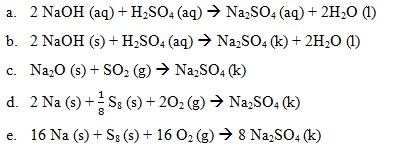
Jawaban : D
Pembahasan:
Perubahan entalpi pembentukan standar merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan stabil, pada 25°C dan tekanan 1 atm. Perubahan entalpi pembentukan standar suatu zat ditentukan dengan menggunakan rumus:
ΔHfo reaksi = ∑ ΔHf° hasil – ∑ΔHf° pereaksi
Reaksi pembentukan ΔHf° Na2SO4
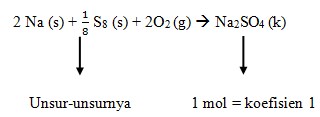
2. Diantara persamaan termokimia di bawah ini yang merupakan perubahan entalpi penguraian adalah…
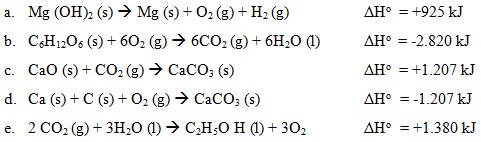
Jawaban: A
Pembahasan:
Perubahan entalpi penguraian standar adalah perubahan entalpi yang terjadi pada penguraian 1 mol suatu senyawa menjadi unsur-unsurnya yang paling stabil pada keadaan standar.
Pada dasarnya, perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tandanya. Jadi dari pilihan ganda yang di atas, jawaban yang tepat adalah A karena reaktannya berupa satu mol menjadi unsur-unsurnya.
(B) 578, 1.820, dan 2.750
(C) 736, 1.450, dan 7.730
(D) 786, 1.580, dan 3.230
(E) 1.012, 1.904, dan 2.190
Pembahasan
Na merupakan unsur yang terletak pada golongan 1A dengan konfigurasi elektron 1s2 2s2 2p6 3s1 (2-8-1). Stabil ketika ia melepaskan elektron pertama (membentuk Na+) konfigurasi elektron Na 2-8.
Bila suatu spesi stabil (biasa elektron valensinya 8 seperti pada Na+) maka diperlukan energi yang besar untuk melepaskan lagi elektron yang dimiliki. Ini ditandai dengan energi ionisasi yang melonjak sangat besar dari sebelumnya.
(B) 577, 1.816, 2.744, 11.576, 14.829, 18.375
(C) 1.090, 2.350, 4.620, 6.220, 37.830, 47.280
(D) 1.400, 2.860, 4.580, 7.480, 9.400, 53.270
(E) 1.680, 3.370, 6.050, 8.410, 11,020, 15.160
Senyawa ionik X2O3 → X3+ + O2–
Karena X stabil setelah melepaskan 3 elektron (ditandai dengan muatan 3+ saat membentuk senyawa) maka untuk melepaskan elektron keempat energi ionisasinya menjadi sangat besar, melonjak, naik drastis, dari energi ionisasi ketiga ke energi ionisasi keempat.
a. Elekcron valensi
b. Kecendrungan membentuk konfigurasi electron gas mulia
c. Lintasan electron
d. Neutron dalam inti atom
e. Proton dan neutron
Jawaban : B
Pembahasan:
Unsur-unsur gas mulia sukar bereaksi karena unsur-unsur tersebut tergolong unsur yang stabil. Menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Setiap atom dalam pembentukan senyawa membentuk konfigurasi electron yang stabil, yaitu :
- Konfigurasi electron gas mulia yang disebut konfigurasi octet atau kaidah oktet,
- Sedangkan Helium disebut kaidah duplet.
Atom-atom suatu unsur berusaha mencapai konfigurasi octet atau duplet dengan cara berikatan dengan atom-atom lain.
Ikatan yang terjadi dapat berupa ikatan ion, kovalen dan kovalen koordinasi.
2. Diketahui nomor atom unsur:
A= 3 D= 12
B= 4 E= 9
C= 11 F= 17
Ikatan paling ionic dapat terbentuk antara ….
a. A dengan E
b. A dengan F
c. C dengan E
d. C dengan F
e. B dengan F
Jawaban: C
Pembahasan:
Konfigurasi electron pada soal ini yaitu:
3A= 2 1 12D= 2 8 2
4B= 2 2 9E= 2 7
11C= 2 8 1 17F= 2 8 7
Pada konfigurasi yang ikatan ionic paling kuat yaitu yang bisa mencapai kestabilan sesuai dengan kaidah octet, yang menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Sehingga didapatkan jawabannya yaitu C dengan F, yang unsur C melepas satu electron sedangkan yang unsur F menerima satu electron agar stabil.
a. AX3
b. AX2
c. AX4E
d. AX4
e. AX2E
Jawaban : A
Pembahasan:
- BF3 jumlah electron valensi atom pusat atau Boron(B)= 5
- Jumlah pasangan electron ikatan (x)= 4
- Jumlah pasangan electron bebas E= 0
- Tipe molekul AX3
2. Titik didih SiH4 lebih tinggi daripada CH4 karena ……………..
a. Molekul SiH4 polar, sedangkan CH4 nonpolar
b. Molekul SiH4 bertarikan dengan ikatan hidrogen, sedangkan CH4 tidak
c. Struktur SiH4 berupa molekul raksasa, sedangkan CH4 berupa molekul sederhana
d. Molekul SiH4 mempunyai dipol permanen, sedangkan CH4 tidak
e. Massa molekul relatif SiH4 lebih besar daripada CH4
Jawaban : E
Pembahasan:
Pada deretan hidrida golongan IVA (CH4 = -164, SiH4 = -112, GeH4 = -90, dan SnH4 = -52) terdapat kenaikkan titik didih yang teratur dari CH4 ke GeH4. Hal ini dapat dijelaskan menurut gaya van der Waals yang bekerja pada molekul-molekul tersebut. Massa molekul CH4 paling kecil, maka gaya van der Waals yang bekerja padanya paling lemah. Oleh karena itu titik didihnya paling rendah.
| Zat | ΔHvap (kJ/mol) |
| Argon (Ar) | 6,3 |
| Benzena (C6H6) | 31,0 |
| Etanol (C2H5OH) | 39,3 |
| Air (H2O) | 40,8 |
| Metana (CH4) | 9,2 |
- Argon
- Benzena
- Etanol
- Air
- Metana
Pembahasan:
Menguap sama artinya mengubah partikel cair menjadi gas. Untuk menjadi gas dari cairan maka partikel-partikel yang berinteraksi harus memisahkan diri. Energi penguapan (∆Hvaporation) menunjukkan besar energi yang diperlukan untuk memutuskan interaksi antarpartikel. Semakin kuat interaksi atau gaya tarik-menarik antarpartikel maka dibutuhkan energi penguapan lebih besar. Jadi gaya interaksi terkuat pada soal ini adalah Air dengan ∆Hvaporation terbesar.
2. Gaya dispersi pada molekul-molekul non-polar terjadi akibat adanya ….
A. Dipol-dipol permanen
B. Dipol-dipol sesaat
C. Imbasan dipol poermanen
D. Gaya elektrostatis molekul polar
E. Ikatan hidrogen
Jawaban: B
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
e. 1,90 mol/kg
Jawaban : C
Pembahasan
Basis perhitungan 1 L larutan fruktosa
Kemolalan laerutan fruktosa, m = n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa = 1,476 mol
– menghitung massa air, w air = w larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/Ml x 1000 ml
= 1100 g
Massa fruktosa = n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
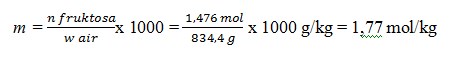
2. Jika didalam zat terlarut dan zat pelarut ada 200 gram air dan dilarutkan 30 gram asam cuka (CH3COOH) fraksi molnya zat terlarut adalah (Ar C = 12, H= 1, O = 16) ….
a. 0,943
b. 0,957
c. 0,987
d. 0,945
e. 0,975
Jawaban : B
Pembahasan :
Mr CH3COOH = 60
M r H2O = 18


Tidak ada komentar:
Posting Komentar