Latihan 3. Buatlah 4 soal Pilihan Ganda dari Kelompok anda
1. Konfigurasi elektron X2- dari suatu unsur 16X adalah…

Jawaban : C
Pembahasan :
menentukan konfigurasi elekton
Unsur x membentuk ion negatif seperti di atas berbarti menerima 2 elektron sehingga jumlah elektronnya menjadi :
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)\
Jawaban : C
Pembahasan :
![]()
- X = lambang unsur
- Z = jumlah proton
- N = nomor atom
- M = massa atom
- Neutron = A – Z
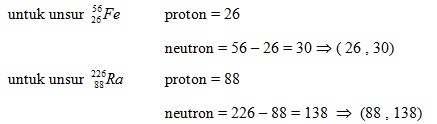
3. Unsur X mempunyai konfigurasi elektron 2, 8, 8, 2. sedangkan unsur Y mempunyai konfigurasi elektron 2, 8, 18, 7. Jika kedua unsur membentuk senyawa, maka rumusnya adalah . . .
![]()
Jawaban : A
Pembahasan :
Unsur X dengan konfigurasi 2, 8, 8, 2 merupakan unsur logam golongan II A.
Unsur Y dengan konfigurasi 2, 8, 18, 7 merupakan unsur halogen golongan VII A.
Golongan halogen bervalensi = 7 terhadap oksigen ; sedangkan terhadap hidrogen dan logam valensinya = 8 – 7 = 1
Golongan II A bervalensi = 2
Jadi rumusnya XY2
4. Jika diketahui nuklida ![]() , maka jumlah elektron, proton dan neutron adalah….
, maka jumlah elektron, proton dan neutron adalah….
A. 23 proton, 12 elektron, 11 neutron
B. 11 proton, 12 elektron, 23 neutron
C. 11 proton, 11 elektron, 12 neutron
D. 11 proton, 12 elektron, 11 neutron
E. 12 proton, 11 elektron, 11 neutron
Jawaban : C
Pembahasan :
![]()
Nomor atom = 11
p = 11
e = 11
Nomor massa = 23
p + n = 23
n = 23 – 11 = 12

Tidak ada komentar:
Posting Komentar